- Generating Transgenic Plants with Single-copy Insertions Using BIBAC-GW Binary Vector За допомогою...
- Generating Transgenic Plants with Single-copy Insertions Using BIBAC-GW Binary Vector
Generating Transgenic Plants with Single-copy Insertions Using BIBAC-GW Binary Vector
Наша взаимовыгодная связь https://banwar.org/
За допомогою системи BIBAC-GW, репортер конструкції для вивчення ODM в рослинах були созданние10. Конструкції були розроблені в pENTR-gm вектора входу шлюза12 і вставляється в pBIBAC бар-GW (рис. 1) з використанням реакції рекомбінації шлюзу LR.
Арабідопсис були перетворені з pDM19, BIBAC-бар-GW плазмида з mTurquoise-eYFP репортер, що перевозять кодоном трансляционная стоп рамка eYFP читання в позиції 120 (mTurquoise2-eYFP * 40) (Малюнок 2) 10. В цілому 126 рослини арабідопсис були перетворюється (9 рослини в горщик, 14 горщики). Насіння цих рослин були об'єднані, посіяли на піддони з грунтом і дозволено рости за два тижні до початку лікування розчином глюфосинату амонію. Тільки саджанці, висловлюючи бар Джин (присутній в BIBAC-бар-GW) вижити глюфосинату амонію лікування (рис. 3). В цілому були визначені 11 мутація перетворена з pDM19, відповідно перетворенню ефективності 0,02% насіння проаналізовані.
Для 11 мутація ізольовані ДНК промокальним був використаний для визначення кількості Т-ДНК інтеграцій. Для цієї мети геномної ДНК був скорочений з Bgl II або Sca я (стратегія розроблена на малюнку 4A). Обидва цих ензимів обмеження тільки один раз розрізати на T-ДНК послідовності (рис. 7A). Гібридизації з зондами, визнаючи бар і eYFP, що кодують області допускається визначення числа відповідних фрагментів ДНК.
Кількість окремих ДНК фрагментів на помарки, допускається для оцінки кількості вставок T-ДНК в лінії репортер (Таблиця 1). Один гібридизувати фрагментів з бару і eYFP зонда вказано наявність єдиного інтеграції T-ДНК. Від 11 мутація проаналізовані шість здійснюється однією інтеграцій. Середня кількість впроваджень був 1.2.
Для 6 ліній, що перевозять один інтеграції T-ДНК цілісність конструкції вставленої репортер був випробуваний з використанням ДНК промокальним (стратегія розроблена на малюнку 4В). Геномна ДНК був скорочений з Bgl II і Pci я випустити 5,5 КБ фрагмент, що містить Джин фьюжн бар і mTurquoise-eYFP (рис. 7A). Зонд проти eYFP був використаний для визначення очікуваного фрагмент. Всі заводи випробування перевозяться фрагмент недоторканими. Зверніть увагу, що фрагмент вивчені виключає зліва і право T-ДНК кордону і тому не перевіряє цілісність всього T-ДНК, але тільки частина, яка містить трансгенів інтерес.
Експресії гена флуоресцентні репортер був визначений в незалежних поштучно трансгенних ліній тільки відрізняються геномної розташування T-ДНК. Відносне стенограми рівні репортер ініціативи промоутер mTurquoise-eYFP CaMV 35S були виміряні за RT-ПЛР в чотири лінії репортер DM19, що перевозять недоторканими, однієї копії інтеграцій, з яких геномні позиція була определени10. Зміни в рівнях вираження гена репортера між лініями був незначним: максимальна різниця в рівнях РНК mTurquoise-eYFP був в 2 рази (рис. 8A).
Далі в ці лінії репортер була проведена ODM. Три з чотирьох ліній незалежним репортером показали досить аналогічні ODM ефективності (Малюнок 8B). Однак, одна лінія, DM19 [4] 1, принесли досить низька ефективність ODM, в порівнянні з іншими лініями. Ці результати показують, що ODM залежить від місцевих геномної контексту. Яким чином місцеві геномної контексті інтеграції T-ДНК в DM19 [4] 1 відрізняється від інших ліній належить визначити. Аналіз доступних наборів знаків активних і неактивних хроматину в геномної місцях інтеграції T-ДНК в НЕ трансгенних рослин не представила ответ10.
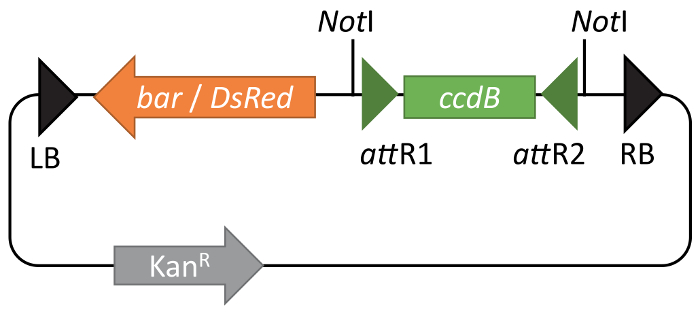
Малюнок 1: функціональні карти pBIBAC-GW векторів. pBIBAC-GW похідні доступні або опір до глюфосинату (бар) або DsRed флуоресценції в насіння пальто (DsRed) як маркер виділення в рослинах. Для обох векторів канаміцин опору ген являє маркер виділення бактерій. Шлюз, ccdB касети відображається між зелених стрілок, що представляють рекомбінації сайтів att R1 і att R2. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 2: конструкція репортер мутагенезу. MTurquoise-eYFP репортер гени рухає promotor 35S CaMV. MTurquoise кодування регіону зливається з eYFP, кодування регіону перевозять CA мутації в нуклеотидної позиції 120, що призводить до передчасної зупинки трансляционная кодон TAA і дострокове припинення перекладу синтез білка. 3 'Nopaline синтетази (3' nos) сплайсингу сигнал використовується для завершення транскрипції конструкціі22. Сигнал ядерної локалізації (NLS) використовується для переведених білків в ядро. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 3: лоток заповнений Arabidopsis саджанців до і після лікування глюфосинату амонію. Саджанці, не виказуючи бар ген, який присутній в pBIBAC бар-GW T-ДНК вмирають після обприскують розчином глюфосинату амонію. Фотографії показують же лоток для розсади (A) перед розпиленням з глюфосинату амонію, через 14 днів після посіву і (B) 10 днів по тому, після розпорошується двічі. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
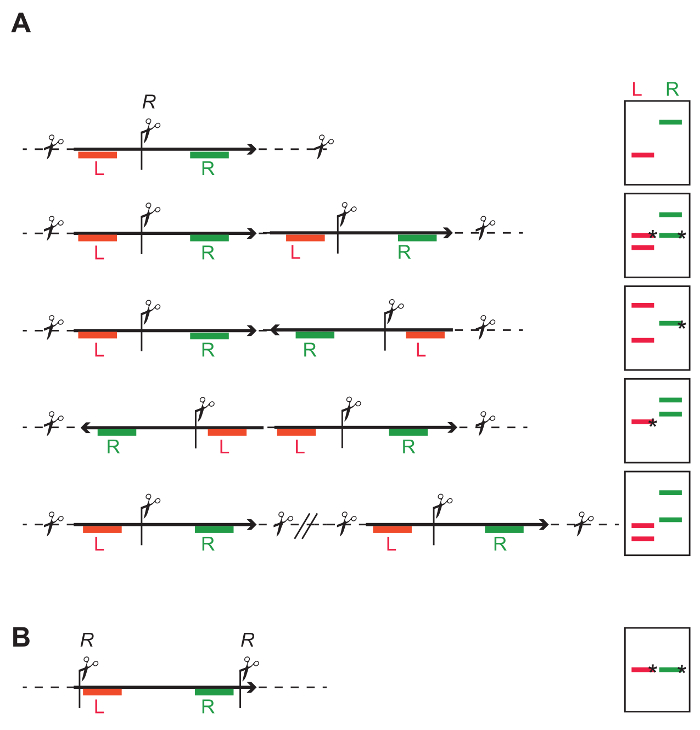
Малюнок 4: стратегії обмеження загального ДНК для визначення числа і цілісності з вставлені T-Уну. (A) одне обмеження сайту (R) в середині T-ДНК дозволяє незалежним зондуючого зліва (червоний Л) і правою частиною T-ДНК (зелений R). Мультфільми про право показують, що в залежності від інтеграції з одне - або multi - копіювати T-ДНК, різних діапазонів візерунки виходять з промокальним ДНК. Смуг, відмічені * має певної довжини, в той час як тривалість інших груп залежить від найближчого сайту обмеження фланкіруя геномної ДНК. Однією вставки: L і R зонд обидва дають один незалежний фрагмент. Розмір очікуваних середньому фрагментів може розраховуватися на основі на частоті обмеження сайту в геномі. Мінімальний розмір - це відстань від місця обмеження на лівій межі (LB) або правій межі (РБ), в залежності від чого інтеграції є бути досліджений, і якщо Т-ДНК недоторканими. Тандемі повторити: Зонди для L і R дають обидва двох фрагментів; для кожного датчика, один з фрагментів включає флангові геномної ДНК другий фрагмент має очікуваний розмір і ідентифікується як зонди. Інвертований повторити: В залежності від спрямованості комплексної касету один L і два R фрагментів, або два L і один R можуть бути визначені. Окремих одного вставки: Результатом є число незалежних фрагментів, і кількість фрагментів відповідає числу впроваджень. (B) обмеження сайтів на кінцях T-ДНК дозволяє визначити цілісність фрагмента між місця обмеження. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
Малюнок 5: агарозному гелі з обмеженням шаблону і відповідності прозорості. (A) на гелі агарози дна genomic перетравлюється з EcoR я показано. Правильне травлення ДНК свідчить наявність дискретних супутникової смуги. (B) Маркування позиції слотів і маркер смуг на прозорості робить можливим пізніше легко обчислити розмір гібридизувати фрагментів. Тут використовуються маркери MRC Голландії (синій і червоний), позначається м. будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
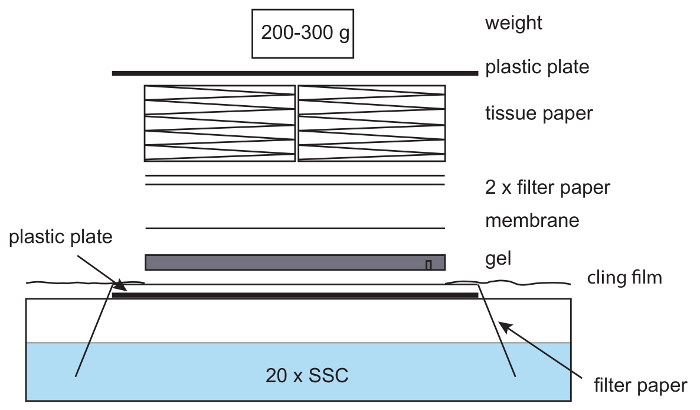
Малюнок 6: Налаштування для капілярної blotting. У капіляр промокальним установки фільтрувальна папір поміщається на пластиковій пластині з кінця паперу, висить в 20 x SSC буфера. Папір зволожений з 20 x SSC і гелю агарози, розміщений на вершині, слідують мембрани нейлону, фільтрувальна папір і стек тканин. Легка вага знаходиться на вершині. Обережність для видалення бульбашок повітря між гель, папір і мембрани. Чіплятися плівки використовується щоб уникнути висихання установки. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
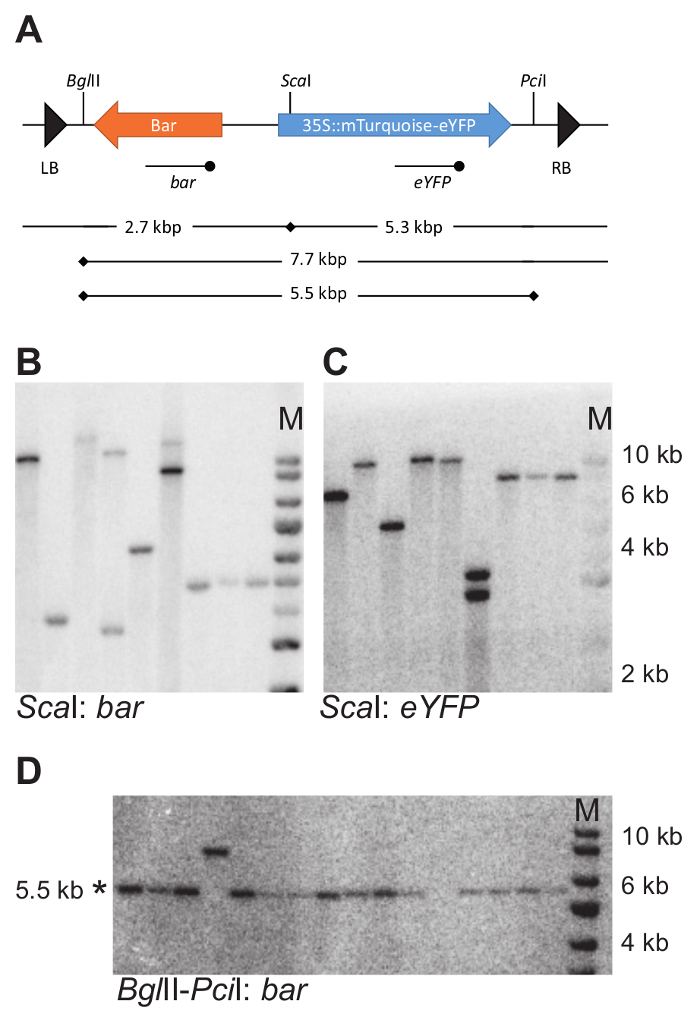
Малюнок 7: приклад ДНК промокальним стратегії і експериментальних результатів. (A) ДНК промокальним стратегії для визначення числа і цілісності T-ДНК інтеграцій. Різка розташування обраного ензимів обмеження в T-ДНК вказані з вертикальною лінією. EYFP і бар датчики, які використовуються для гібридизації з перетравлюється геномної ДНК, вказані за допомогою рядка з терміналу точкою нижче T-ДНК. (D B -) Приклад ДНК помарок. Геномна ДНК був скорочений з Sca я і пляма було досліджено з бар і eYFP зонда (B і C). Геномна ДНК був вирізати з Bgl II і Pci я і досліджений з зондом бар. Недоторканими фрагменти є 5,5 kbp в розмір (D). Зверніть увагу, що набір зразків в D відрізняється від зазначених в B і C. * вказує розмір очікуваного фрагментів; М, маркер. В B, C і D використовується же розмір маркера. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 8: рівні вираження mTurquoise-eYFP і ODM ефективності лінії репортер незалежних mTurquoise-eYFP. (A) відносна mTurquoise-eYFP Стенограма рівнях вимірюється RT-ПЛР в DM19 репортер ліній. Для нормалізації Стенограма рівні актину були використані. (B) ODM ефективність вимірюється в лініях репортер DM19. Для A і B, бари вказують в середньому не менше п'яти біологічних реплицирует. Планки похибок вказують SEM. будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
Тип T-ДНК Локус Кількість впроваджень T-ДНК Репортер лінія Кількість виявлених фрагментів Цілісність SCA Я BGL II BGL II / PciI Бар eYFP Бар eYFP eYFP Інтеграція в одному локусі 1 19 [2] -2 1 1 1 1 + 1 19 [2] -5 1 1 1 1 + 1 19 [2] -9 1 1 1 1 + 1 19 [2] -11 1 1 1 1 + 1 19 [4] -1 1 1 1 1 + 1 19 [4] -2 1 + 1 1 + 1 + 2, Перевернутий повторити 19 [2] -10 2 1 + 1 1 +2, неповної інтеграції 19 [2] -3 1 2 1 1 ND Кілька Локус інтеграцій 2 19 [2] -6 2 2 2 ND 2 19 [2] -7 2 2 2 2 ND 3/4 19 [2] -1 4 3 3 3 ND ND - не визначений.
Таблиця 1: Резюме промокальним даних для ізоляції після перетворення з pDM19 мутація ДНК.
Generating Transgenic Plants with Single-copy Insertions Using BIBAC-GW Binary Vector
За допомогою системи BIBAC-GW, репортер конструкції для вивчення ODM в рослинах були созданние10. Конструкції були розроблені в pENTR-gm вектора входу шлюза12 і вставляється в pBIBAC бар-GW (рис. 1) з використанням реакції рекомбінації шлюзу LR.
Арабідопсис були перетворені з pDM19, BIBAC-бар-GW плазмида з mTurquoise-eYFP репортер, що перевозять кодоном трансляционная стоп рамка eYFP читання в позиції 120 (mTurquoise2-eYFP * 40) (Малюнок 2) 10. В цілому 126 рослини арабідопсис були перетворюється (9 рослини в горщик, 14 горщики). Насіння цих рослин були об'єднані, посіяли на піддони з грунтом і дозволено рости за два тижні до початку лікування розчином глюфосинату амонію. Тільки саджанці, висловлюючи бар Джин (присутній в BIBAC-бар-GW) вижити глюфосинату амонію лікування (рис. 3). В цілому були визначені 11 мутація перетворена з pDM19, відповідно перетворенню ефективності 0,02% насіння проаналізовані.
Для 11 мутація ізольовані ДНК промокальним був використаний для визначення кількості Т-ДНК інтеграцій. Для цієї мети геномної ДНК був скорочений з Bgl II або Sca я (стратегія розроблена на малюнку 4A). Обидва цих ензимів обмеження тільки один раз розрізати на T-ДНК послідовності (рис. 7A). Гібридизації з зондами, визнаючи бар і eYFP, що кодують області допускається визначення числа відповідних фрагментів ДНК.
Кількість окремих ДНК фрагментів на помарки, допускається для оцінки кількості вставок T-ДНК в лінії репортер (Таблиця 1). Один гібридизувати фрагментів з бару і eYFP зонда вказано наявність єдиного інтеграції T-ДНК. Від 11 мутація проаналізовані шість здійснюється однією інтеграцій. Середня кількість впроваджень був 1.2.
Для 6 ліній, що перевозять один інтеграції T-ДНК цілісність конструкції вставленої репортер був випробуваний з використанням ДНК промокальним (стратегія розроблена на малюнку 4В). Геномна ДНК був скорочений з Bgl II і Pci я випустити 5,5 КБ фрагмент, що містить Джин фьюжн бар і mTurquoise-eYFP (рис. 7A). Зонд проти eYFP був використаний для визначення очікуваного фрагмент. Всі заводи випробування перевозяться фрагмент недоторканими. Зверніть увагу, що фрагмент вивчені виключає зліва і право T-ДНК кордону і тому не перевіряє цілісність всього T-ДНК, але тільки частина, яка містить трансгенів інтерес.
Експресії гена флуоресцентні репортер був визначений в незалежних поштучно трансгенних ліній тільки відрізняються геномної розташування T-ДНК. Відносне стенограми рівні репортер ініціативи промоутер mTurquoise-eYFP CaMV 35S були виміряні за RT-ПЛР в чотири лінії репортер DM19, що перевозять недоторканими, однієї копії інтеграцій, з яких геномні позиція була определени10. Зміни в рівнях вираження гена репортера між лініями був незначним: максимальна різниця в рівнях РНК mTurquoise-eYFP був в 2 рази (рис. 8A).
Далі в ці лінії репортер була проведена ODM. Три з чотирьох ліній незалежним репортером показали досить аналогічні ODM ефективності (Малюнок 8B). Однак, одна лінія, DM19 [4] 1, принесли досить низька ефективність ODM, в порівнянні з іншими лініями. Ці результати показують, що ODM залежить від місцевих геномної контексту. Яким чином місцеві геномної контексті інтеграції T-ДНК в DM19 [4] 1 відрізняється від інших ліній належить визначити. Аналіз доступних наборів знаків активних і неактивних хроматину в геномної місцях інтеграції T-ДНК в НЕ трансгенних рослин не представила ответ10.

Малюнок 1: функціональні карти pBIBAC-GW векторів. pBIBAC-GW похідні доступні або опір до глюфосинату (бар) або DsRed флуоресценції в насіння пальто (DsRed) як маркер виділення в рослинах. Для обох векторів канаміцин опору ген являє маркер виділення бактерій. Шлюз, ccdB касети відображається між зелених стрілок, що представляють рекомбінації сайтів att R1 і att R2. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 2: конструкція репортер мутагенезу. MTurquoise-eYFP репортер гени рухає promotor 35S CaMV. MTurquoise кодування регіону зливається з eYFP, кодування регіону перевозять CA мутації в нуклеотидної позиції 120, що призводить до передчасної зупинки трансляционная кодон TAA і дострокове припинення перекладу синтез білка. 3 'Nopaline синтетази (3' nos) сплайсингу сигнал використовується для завершення транскрипції конструкціі22. Сигнал ядерної локалізації (NLS) використовується для переведених білків в ядро. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 3: лоток заповнений Arabidopsis саджанців до і після лікування глюфосинату амонію. Саджанці, не виказуючи бар ген, який присутній в pBIBAC бар-GW T-ДНК вмирають після обприскують розчином глюфосинату амонію. Фотографії показують же лоток для розсади (A) перед розпиленням з глюфосинату амонію, через 14 днів після посіву і (B) 10 днів по тому, після розпорошується двічі. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 4: стратегії обмеження загального ДНК для визначення числа і цілісності з вставлені T-Уну. (A) одне обмеження сайту (R) в середині T-ДНК дозволяє незалежним зондуючого зліва (червоний Л) і правою частиною T-ДНК (зелений R). Мультфільми про право показують, що в залежності від інтеграції з одне - або multi - копіювати T-ДНК, різних діапазонів візерунки виходять з промокальним ДНК. Смуг, відмічені * має певної довжини, в той час як тривалість інших груп залежить від найближчого сайту обмеження фланкіруя геномної ДНК. Однією вставки: L і R зонд обидва дають один незалежний фрагмент. Розмір очікуваних середньому фрагментів може розраховуватися на основі на частоті обмеження сайту в геномі. Мінімальний розмір - це відстань від місця обмеження на лівій межі (LB) або правій межі (РБ), в залежності від чого інтеграції є бути досліджений, і якщо Т-ДНК недоторканими. Тандемі повторити: Зонди для L і R дають обидва двох фрагментів; для кожного датчика, один з фрагментів включає флангові геномної ДНК другий фрагмент має очікуваний розмір і ідентифікується як зонди. Інвертований повторити: В залежності від спрямованості комплексної касету один L і два R фрагментів, або два L і один R можуть бути визначені. Окремих одного вставки: Результатом є число незалежних фрагментів, і кількість фрагментів відповідає числу впроваджень. (B) обмеження сайтів на кінцях T-ДНК дозволяє визначити цілісність фрагмента між місця обмеження. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 5: агарозному гелі з обмеженням шаблону і відповідності прозорості. (A) на гелі агарози дна genomic перетравлюється з EcoR я показано. Правильне травлення ДНК свідчить наявність дискретних супутникової смуги. (B) Маркування позиції слотів і маркер смуг на прозорості робить можливим пізніше легко обчислити розмір гібридизувати фрагментів. Тут використовуються маркери MRC Голландії (синій і червоний), позначається м. будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 6: Налаштування для капілярної blotting. У капіляр промокальним установки фільтрувальна папір поміщається на пластиковій пластині з кінця паперу, висить в 20 x SSC буфера. Папір зволожений з 20 x SSC і гелю агарози, розміщений на вершині, слідують мембрани нейлону, фільтрувальна папір і стек тканин. Легка вага знаходиться на вершині. Обережність для видалення бульбашок повітря між гель, папір і мембрани. Чіплятися плівки використовується щоб уникнути висихання установки. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 7: приклад ДНК промокальним стратегії і експериментальних результатів. (A) ДНК промокальним стратегії для визначення числа і цілісності T-ДНК інтеграцій. Різка розташування обраного ензимів обмеження в T-ДНК вказані з вертикальною лінією. EYFP і бар датчики, які використовуються для гібридизації з перетравлюється геномної ДНК, вказані за допомогою рядка з терміналу точкою нижче T-ДНК. (D B -) Приклад ДНК помарок. Геномна ДНК був скорочений з Sca я і пляма було досліджено з бар і eYFP зонда (B і C). Геномна ДНК був вирізати з Bgl II і Pci я і досліджений з зондом бар. Недоторканими фрагменти є 5,5 kbp в розмір (D). Зверніть увагу, що набір зразків в D відрізняється від зазначених в B і C. * вказує розмір очікуваного фрагментів; М, маркер. В B, C і D використовується же розмір маркера. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 8: рівні вираження mTurquoise-eYFP і ODM ефективності лінії репортер незалежних mTurquoise-eYFP. (A) відносна mTurquoise-eYFP Стенограма рівнях вимірюється RT-ПЛР в DM19 репортер ліній. Для нормалізації Стенограма рівні актину були використані. (B) ODM ефективність вимірюється в лініях репортер DM19. Для A і B, бари вказують в середньому не менше п'яти біологічних реплицирует. Планки похибок вказують SEM. будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
Тип T-ДНК Локус Кількість впроваджень T-ДНК Репортер лінія Кількість виявлених фрагментів Цілісність SCA Я BGL II BGL II / PciI Бар eYFP Бар eYFP eYFP Інтеграція в одному локусі 1 19 [2] -2 1 1 1 1 + 1 19 [2] -5 1 1 1 1 + 1 19 [2] -9 1 1 1 1 + 1 19 [2] -11 1 1 1 1 + 1 19 [4] -1 1 1 1 1 + 1 19 [4] -2 1 + 1 1 + 1 + 2, Перевернутий повторити 19 [2] -10 2 1 + 1 1 +2, неповної інтеграції 19 [2] -3 1 2 1 1 ND Кілька Локус інтеграцій 2 19 [2] -6 2 2 2 ND 2 19 [2] -7 2 2 2 2 ND 3/4 19 [2] -1 4 3 3 3 ND ND - не визначений.
Таблиця 1: Резюме промокальним даних для ізоляції після перетворення з pDM19 мутація ДНК.
Generating Transgenic Plants with Single-copy Insertions Using BIBAC-GW Binary Vector
За допомогою системи BIBAC-GW, репортер конструкції для вивчення ODM в рослинах були созданние10. Конструкції були розроблені в pENTR-gm вектора входу шлюза12 і вставляється в pBIBAC бар-GW (рис. 1) з використанням реакції рекомбінації шлюзу LR.
Арабідопсис були перетворені з pDM19, BIBAC-бар-GW плазмида з mTurquoise-eYFP репортер, що перевозять кодоном трансляционная стоп рамка eYFP читання в позиції 120 (mTurquoise2-eYFP * 40) (Малюнок 2) 10. В цілому 126 рослини арабідопсис були перетворюється (9 рослини в горщик, 14 горщики). Насіння цих рослин були об'єднані, посіяли на піддони з грунтом і дозволено рости за два тижні до початку лікування розчином глюфосинату амонію. Тільки саджанці, висловлюючи бар Джин (присутній в BIBAC-бар-GW) вижити глюфосинату амонію лікування (рис. 3). В цілому були визначені 11 мутація перетворена з pDM19, відповідно перетворенню ефективності 0,02% насіння проаналізовані.
Для 11 мутація ізольовані ДНК промокальним був використаний для визначення кількості Т-ДНК інтеграцій. Для цієї мети геномної ДНК був скорочений з Bgl II або Sca я (стратегія розроблена на малюнку 4A). Обидва цих ензимів обмеження тільки один раз розрізати на T-ДНК послідовності (рис. 7A). Гібридизації з зондами, визнаючи бар і eYFP, що кодують області допускається визначення числа відповідних фрагментів ДНК.
Кількість окремих ДНК фрагментів на помарки, допускається для оцінки кількості вставок T-ДНК в лінії репортер (Таблиця 1). Один гібридизувати фрагментів з бару і eYFP зонда вказано наявність єдиного інтеграції T-ДНК. Від 11 мутація проаналізовані шість здійснюється однією інтеграцій. Середня кількість впроваджень був 1.2.
Для 6 ліній, що перевозять один інтеграції T-ДНК цілісність конструкції вставленої репортер був випробуваний з використанням ДНК промокальним (стратегія розроблена на малюнку 4В). Геномна ДНК був скорочений з Bgl II і Pci я випустити 5,5 КБ фрагмент, що містить Джин фьюжн бар і mTurquoise-eYFP (рис. 7A). Зонд проти eYFP був використаний для визначення очікуваного фрагмент. Всі заводи випробування перевозяться фрагмент недоторканими. Зверніть увагу, що фрагмент вивчені виключає зліва і право T-ДНК кордону і тому не перевіряє цілісність всього T-ДНК, але тільки частина, яка містить трансгенів інтерес.
Експресії гена флуоресцентні репортер був визначений в незалежних поштучно трансгенних ліній тільки відрізняються геномної розташування T-ДНК. Відносне стенограми рівні репортер ініціативи промоутер mTurquoise-eYFP CaMV 35S були виміряні за RT-ПЛР в чотири лінії репортер DM19, що перевозять недоторканими, однієї копії інтеграцій, з яких геномні позиція була определени10. Зміни в рівнях вираження гена репортера між лініями був незначним: максимальна різниця в рівнях РНК mTurquoise-eYFP був в 2 рази (рис. 8A).
Далі в ці лінії репортер була проведена ODM. Три з чотирьох ліній незалежним репортером показали досить аналогічні ODM ефективності (Малюнок 8B). Однак, одна лінія, DM19 [4] 1, принесли досить низька ефективність ODM, в порівнянні з іншими лініями. Ці результати показують, що ODM залежить від місцевих геномної контексту. Яким чином місцеві геномної контексті інтеграції T-ДНК в DM19 [4] 1 відрізняється від інших ліній належить визначити. Аналіз доступних наборів знаків активних і неактивних хроматину в геномної місцях інтеграції T-ДНК в НЕ трансгенних рослин не представила ответ10.

Малюнок 1: функціональні карти pBIBAC-GW векторів. pBIBAC-GW похідні доступні або опір до глюфосинату (бар) або DsRed флуоресценції в насіння пальто (DsRed) як маркер виділення в рослинах. Для обох векторів канаміцин опору ген являє маркер виділення бактерій. Шлюз, ccdB касети відображається між зелених стрілок, що представляють рекомбінації сайтів att R1 і att R2. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 2: конструкція репортер мутагенезу. MTurquoise-eYFP репортер гени рухає promotor 35S CaMV. MTurquoise кодування регіону зливається з eYFP, кодування регіону перевозять CA мутації в нуклеотидної позиції 120, що призводить до передчасної зупинки трансляционная кодон TAA і дострокове припинення перекладу синтез білка. 3 'Nopaline синтетази (3' nos) сплайсингу сигнал використовується для завершення транскрипції конструкціі22. Сигнал ядерної локалізації (NLS) використовується для переведених білків в ядро. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 3: лоток заповнений Arabidopsis саджанців до і після лікування глюфосинату амонію. Саджанці, не виказуючи бар ген, який присутній в pBIBAC бар-GW T-ДНК вмирають після обприскують розчином глюфосинату амонію. Фотографії показують же лоток для розсади (A) перед розпиленням з глюфосинату амонію, через 14 днів після посіву і (B) 10 днів по тому, після розпорошується двічі. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 4: стратегії обмеження загального ДНК для визначення числа і цілісності з вставлені T-Уну. (A) одне обмеження сайту (R) в середині T-ДНК дозволяє незалежним зондуючого зліва (червоний Л) і правою частиною T-ДНК (зелений R). Мультфільми про право показують, що в залежності від інтеграції з одне - або multi - копіювати T-ДНК, різних діапазонів візерунки виходять з промокальним ДНК. Смуг, відмічені * має певної довжини, в той час як тривалість інших груп залежить від найближчого сайту обмеження фланкіруя геномної ДНК. Однією вставки: L і R зонд обидва дають один незалежний фрагмент. Розмір очікуваних середньому фрагментів може розраховуватися на основі на частоті обмеження сайту в геномі. Мінімальний розмір - це відстань від місця обмеження на лівій межі (LB) або правій межі (РБ), в залежності від чого інтеграції є бути досліджений, і якщо Т-ДНК недоторканими. Тандемі повторити: Зонди для L і R дають обидва двох фрагментів; для кожного датчика, один з фрагментів включає флангові геномної ДНК другий фрагмент має очікуваний розмір і ідентифікується як зонди. Інвертований повторити: В залежності від спрямованості комплексної касету один L і два R фрагментів, або два L і один R можуть бути визначені. Окремих одного вставки: Результатом є число незалежних фрагментів, і кількість фрагментів відповідає числу впроваджень. (B) обмеження сайтів на кінцях T-ДНК дозволяє визначити цілісність фрагмента між місця обмеження. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 5: агарозному гелі з обмеженням шаблону і відповідності прозорості. (A) на гелі агарози дна genomic перетравлюється з EcoR я показано. Правильне травлення ДНК свідчить наявність дискретних супутникової смуги. (B) Маркування позиції слотів і маркер смуг на прозорості робить можливим пізніше легко обчислити розмір гібридизувати фрагментів. Тут використовуються маркери MRC Голландії (синій і червоний), позначається м. будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 6: Налаштування для капілярної blotting. У капіляр промокальним установки фільтрувальна папір поміщається на пластиковій пластині з кінця паперу, висить в 20 x SSC буфера. Папір зволожений з 20 x SSC і гелю агарози, розміщений на вершині, слідують мембрани нейлону, фільтрувальна папір і стек тканин. Легка вага знаходиться на вершині. Обережність для видалення бульбашок повітря між гель, папір і мембрани. Чіплятися плівки використовується щоб уникнути висихання установки. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 7: приклад ДНК промокальним стратегії і експериментальних результатів. (A) ДНК промокальним стратегії для визначення числа і цілісності T-ДНК інтеграцій. Різка розташування обраного ензимів обмеження в T-ДНК вказані з вертикальною лінією. EYFP і бар датчики, які використовуються для гібридизації з перетравлюється геномної ДНК, вказані за допомогою рядка з терміналу точкою нижче T-ДНК. (D B -) Приклад ДНК помарок. Геномна ДНК був скорочений з Sca я і пляма було досліджено з бар і eYFP зонда (B і C). Геномна ДНК був вирізати з Bgl II і Pci я і досліджений з зондом бар. Недоторканими фрагменти є 5,5 kbp в розмір (D). Зверніть увагу, що набір зразків в D відрізняється від зазначених в B і C. * вказує розмір очікуваного фрагментів; М, маркер. В B, C і D використовується же розмір маркера. Будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.

Малюнок 8: рівні вираження mTurquoise-eYFP і ODM ефективності лінії репортер незалежних mTurquoise-eYFP. (A) відносна mTurquoise-eYFP Стенограма рівнях вимірюється RT-ПЛР в DM19 репортер ліній. Для нормалізації Стенограма рівні актину були використані. (B) ODM ефективність вимірюється в лініях репортер DM19. Для A і B, бари вказують в середньому не менше п'яти біологічних реплицирует. Планки похибок вказують SEM. будь ласка, натисніть тут, щоб подивитися велику версію цієї фігури.
Тип T-ДНК Локус Кількість впроваджень T-ДНК Репортер лінія Кількість виявлених фрагментів Цілісність SCA Я BGL II BGL II / PciI Бар eYFP Бар eYFP eYFP Інтеграція в одному локусі 1 19 [2] -2 1 1 1 1 + 1 19 [2] -5 1 1 1 1 + 1 19 [2] -9 1 1 1 1 + 1 19 [2] -11 1 1 1 1 + 1 19 [4] -1 1 1 1 1 + 1 19 [4] -2 1 + 1 1 + 1 + 2, Перевернутий повторити 19 [2] -10 2 1 + 1 1 +2, неповної інтеграції 19 [2] -3 1 2 1 1 ND Кілька Локус інтеграцій 2 19 [2] -6 2 2 2 ND 2 19 [2] -7 2 2 2 2 ND 3/4 19 [2] -1 4 3 3 3 ND ND - не визначений.
Таблиця 1: Резюме промокальним даних для ізоляції після перетворення з pDM19 мутація ДНК.








